Modèle de pudding aux prunes de Thomson (1911)
Modèle de pouding aux prunes de Thomson est donné par le physicien anglais Sir Joseph JohnJ.J. Thomson. Il a découvert l'électron (première particule subatomique) en 1897. Au moment de la découverte, J.J. Thomson a appelé cette particule chargée négativement comme corpuscules.
Le modèle Plum Pudding de Thomson est le premier modèle à représenter la structure atomique de la matière. Selon Modèle de pouding aux prunes de Thomson, une substance est constituée de petites sphères ayant un rayon d’environ 10-10 m de diamètre. La charge positive est répartie uniformément dans le volume de la sphère appelée pudding. Les particules chargées négativement Des électrons appelés Prunes sont distribuées sous forme de charges ponctuelles dans des coques, comme indiqué dans la figure ci-dessous.
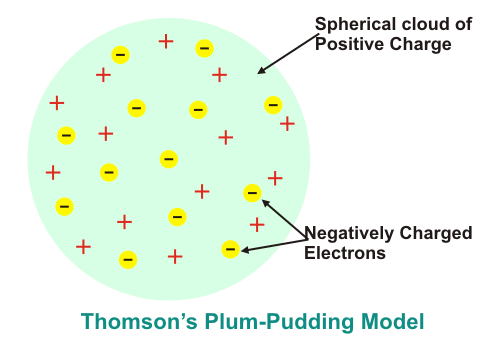
La sphère chargée positivement exerce la force surélectrons chargés négativement. La direction de la force nette sur les électrons chargés négativement en raison de la sphère chargée positivement est vers le centre de la sphère. Ces électrons chargés négativement se repoussent et forment les coquilles.
Modèle de pouding aux prunes de Thomson dominer pendant quelques années jusqu'à ErnestRutherford a annoncé le modèle nucléaire de l'atome en 1911. Après le modèle nucléaire de l'atome d'Ernest Rutherford en 1911, l'intérêt du modèle de Thomson pour le prunier a été rapidement réduit. Mais le modèle Thomson de Prun Pudding a pris sa place dans l’histoire en tant que première tentative moderne de construction d’une théorie de la structure atomique.
le Modèle de pouding aux prunes de Thomson a été abandonné car il n'a pas expliqué laexistence de certains phénomènes observés. Ce modèle n’expliquait pas l’émission de spectre électronique constitué de fréquences différentes de l’atome de Thomson lorsqu’il est soumis à des fréquences externes émises par d’autres substances.
Il n'a pas non plus expliqué l'existence du spectre de la lumière. Par exemple, considérons l'émission de lumière par un atome d'hydrogène à un seul électron. Selon Modèle de pouding aux prunes de Thomson, il peut émettre de la lumière à une seule fréquencealors qu’il émet pratiquement le spectre lumineux constitué de différentes fréquences. En raison de l’échec du modèle Thomson Plum Pudding pour expliquer ce phénomène, ce modèle a été rejeté.
Même si le modèle Thomson de Prun Pudding représente un progrès considérable vers la vérité, il n’explique pas ces faits.
De plus, il ne fournit pas le mécanisme satisfaisant pour expliquer la déviation de la particule α. En 1911, le physicien britannique Ernest Rutherford donna
un modèle atomique capable d'expliquerle phénomène ci-dessus, tel que spectre de l'hydrogène constitué de fréquences différentes, spectre de la lumière composé de fréquences différentes, déflation des particules α dans le champ externe. C’est pourquoi le modèle nucléaire de l’atome d’Ernest Rutherford en 1911 remplace le Modèle de pouding aux prunes de Thomson.